La question des CIPAN et de leur impact a été largement soulevée lors du Week-end du CARI consacré aux relations apiculteurs-agriculteurs. Les principales questions que l’on est en droit de se poser sont les suivantes :
La question des CIPAN et de leur impact a été largement soulevée lors du Week-end du CARI consacré aux relations apiculteurs-agriculteurs. Les principales questions que l’on est en droit de se poser sont les suivantes :
- Dans quelles mesures les abeilles visitent-elles les CIPAN ?
- Sont-elles exposées aux pesticides lorsqu’elles visitent ces ressources ?
- Quel est l’impact des CIPAN sur la colonie et l’hivernage de ce butinage tardif?
Louis Hautier du CRA-W a apporté des réponses à ces questions et a suscité beaucoup d’intérêt dans la salle. Il a présenté les résultats d’un monitoring réalisé en octobre 2017 par le CRA-W et le CARI dans le cadre du projet Bee Wallonie. Le CRA-W a été en charge de l’identification des sites CIPAN. Le CARI (dans le cadre du Programme Miel) a placé les ruches et assuré les récoltes de pollen. Le laboratoire du CARI (toujours dans le cadre du Programme Miel) a effectué les analyses palynologiques. Le CRA-W et le CARI (Louis Hautier et Noa Simon dans le cadre de Bee Wallonie) ont analysé conjointement les données récoltées.
Des fleurs et du pollen de trappe ont été collectés sur 28 sites et des fleurs ont été par ailleurs collectées sur 36 sites en Wallonie.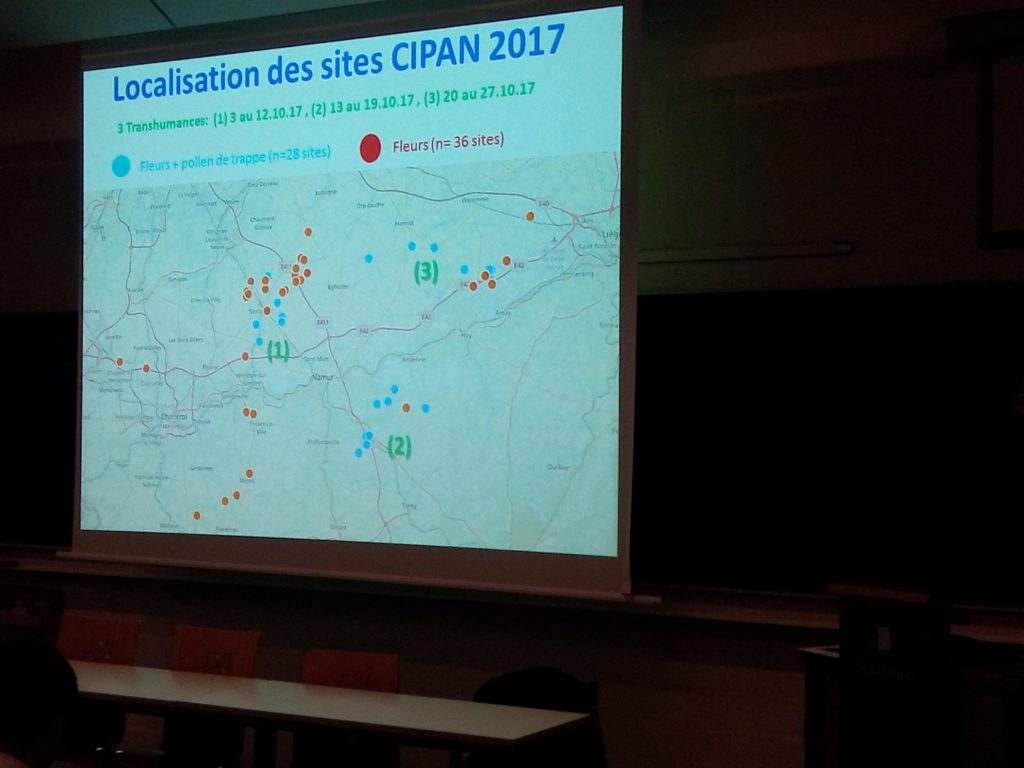 Les rentrées de pollen observées en octobre ont été jugées dans certains cas équivalentes aux rentrées de pollen au printemps.
Les rentrées de pollen observées en octobre ont été jugées dans certains cas équivalentes aux rentrées de pollen au printemps. 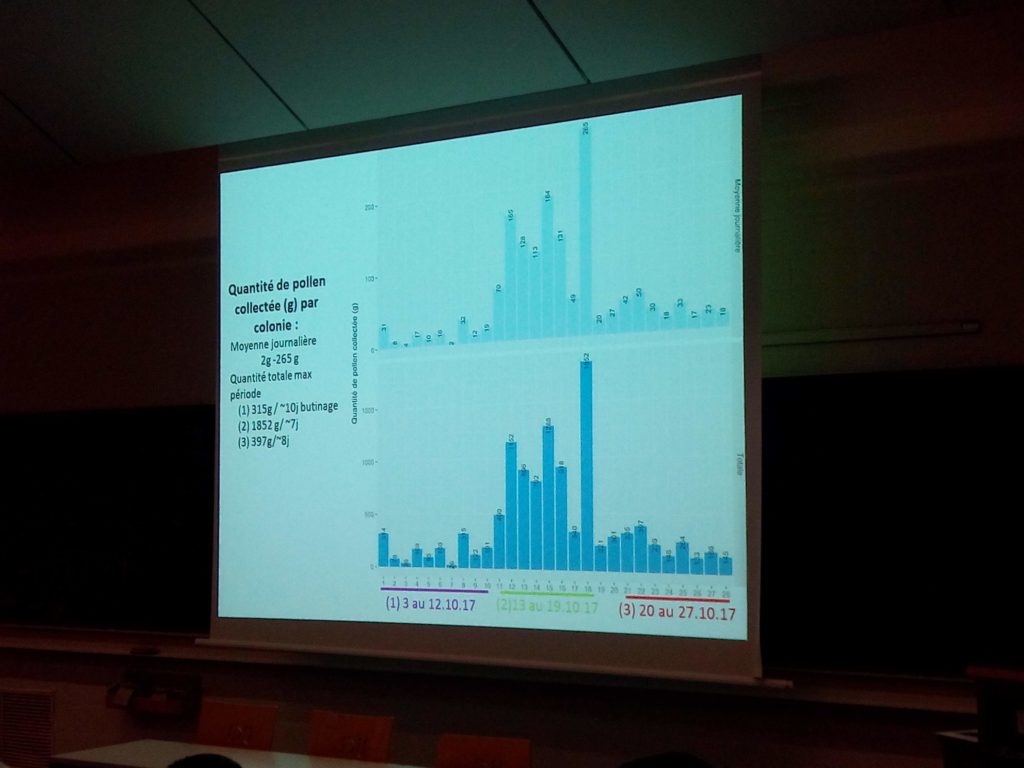
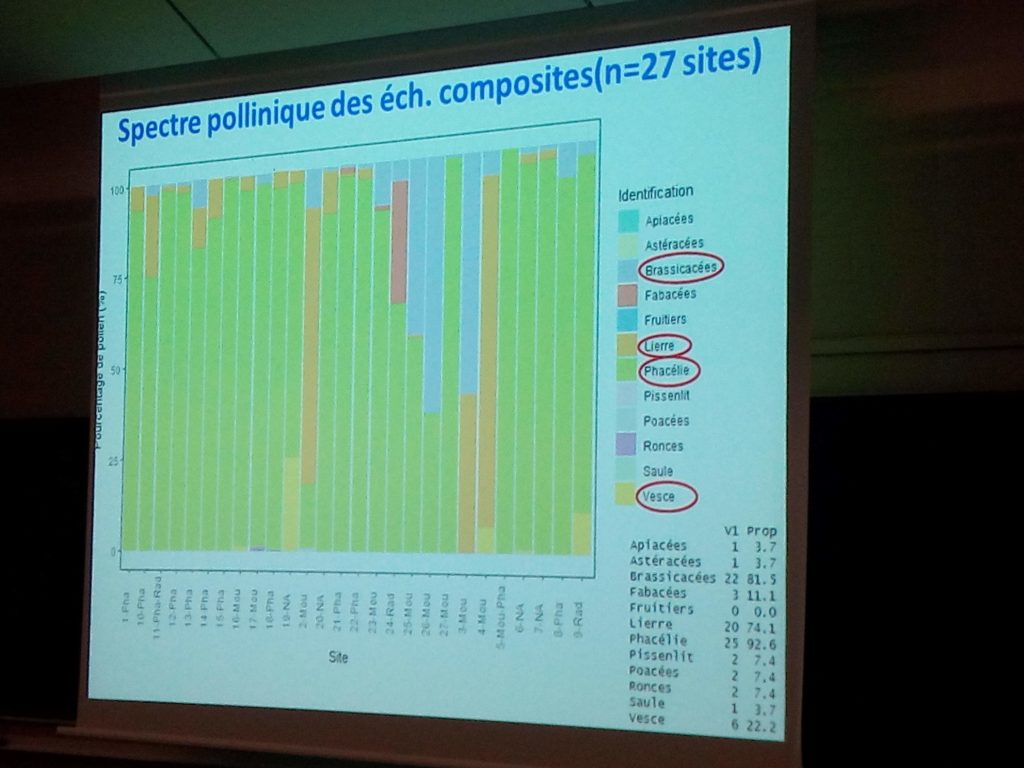
Les analyses palynologiques effectuées par le laboratoire du CARI ont révélé une dominante de phacélie dans les échantillons, y compris dans les échantillons prélevés dans les colonies situées dans les champs de moutarde. A noter que le deuxième pollen récolté, en quantité, est le pollen de lierre.
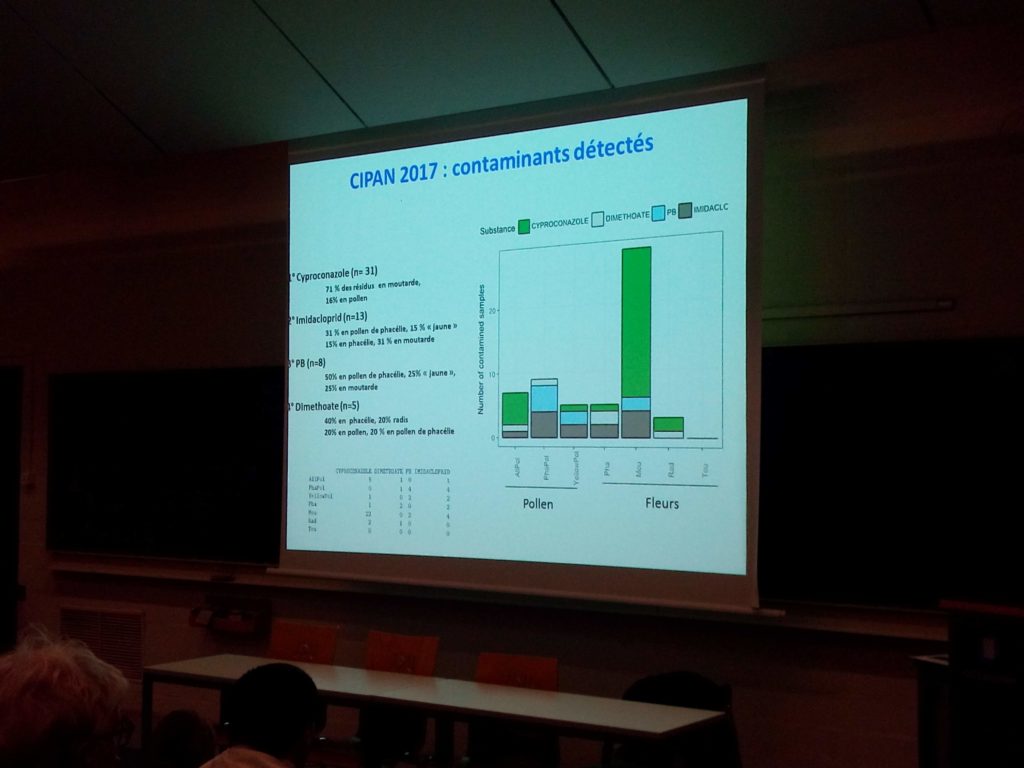
Une analyse multi-résidus a été réalisée sur les échantillons. Sur 64 sites échantillonnés, 40 contenaient des résidus de pesticides et 24 n’en contenaient pas.
25% des deux pollens de phacélie et de moutarde était contaminé, 44% du pollen de phacélie et 38% du pollen de moutarde.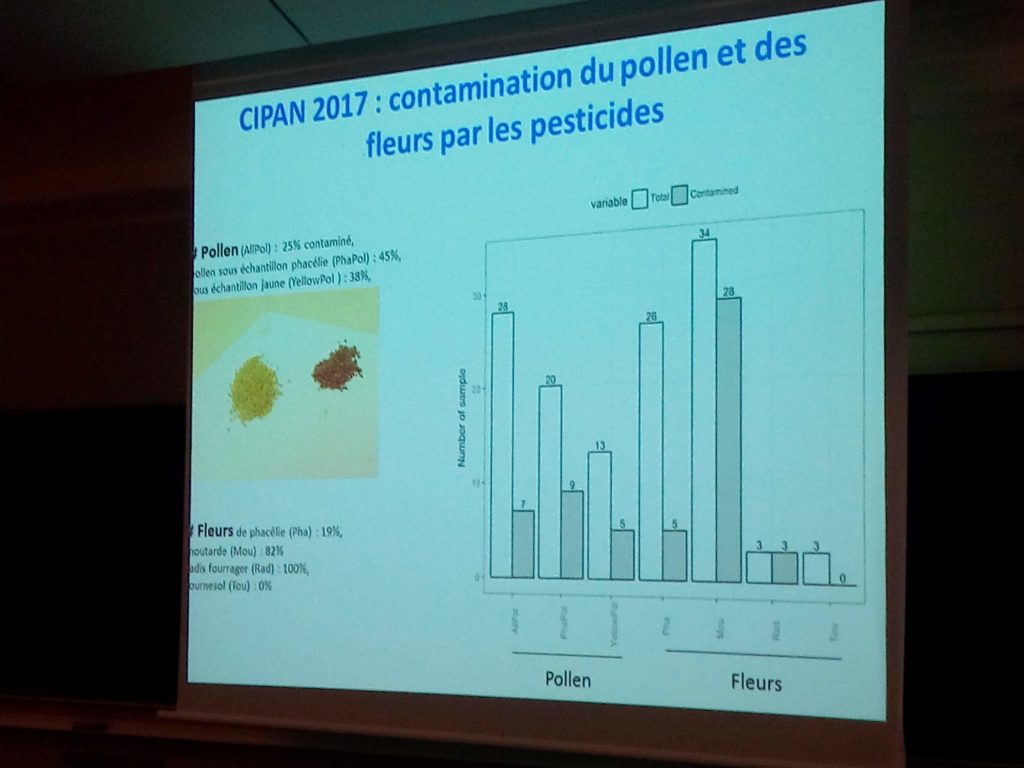
Des résidus de cyproconazole (71% en moutarde, 16% en pollen) ont été retrouvés dans 31 échantillons. Des résidus d’imidaclopride ont été retrouvés dans 13 échantillons. Un synergiste de type butoxyde de pipéronyle (utilisé en association avec des pyréthrinoïdes) a été retrouvé dans 8 échantillons (50% en pollen de phacélie et 25% en pollen de moutarde) et du diméthoate a été retrouvé dans 5 échantillons. Sur l’un des sites d’échantillonnage, Louis Hautier signale des contaminations multiples ayant pu induire un effet cocktail chez les abeilles.
Il semble donc bien que, au vu de ces premiers résultats, les CIPAN puissent être des pièges à pesticides en même temps que des pièges à nitrates. 
Comment expliquer le fait de retrouver des insecticides au moins d’octobre?
Le cyproconazole et l’imidaclopride sont des produits systémiques persistants dans le sol. La présence de butoxyde de pipéronyle et de diméthoate peut s’expliquer par des dérives de pulvérisation sur colza ou céréales. Les bandes fleuries pourraient être également victimes de ces dérives. Une enquête de terrain auprès des agriculteurs pour connaître précisément les traitements effectués est en cours.
Quel est l’impact du butinage tardif des CIPAN?
Louis Hautier a présenté les résultats de plusieurs études analysant l’impact de ce butinage tardif. L’un des impacts est la modification du phénotype et l’accumulation de la vitéllogénine. En l’absence de couvain et de tâches de butinage, les abeilles d’hiver développent des réserves de protéines dans le corps: elles accumulent de la vitéllogénine. Les CIPAN offrent des ressources attractives qui suscitent un comportement de butinage. Dès lors, la quantité de vitéllogénine et de graisse diminue chez les abeilles d’hiver ce qui a un impact sur la survie hivernale de la colonie (1). Une étude française de 2017 (2) aborde le problème des pertes hivernales et de l’environnement en période pré-hivernale dans un contexte paysager. Parmi les paramètres analysés par les chercheurs, l’influence des habitats semi-naturels affecte positivement la santé des abeilles en période pré-hivernale. Enfin, une étude américaine (3) a comparé les pollens récoltés au printemps et à l’automne.

La récolte d’automne est caractérisée par une grande diversité des pollens récoltés alors que le pollen de printemps est dominé par un apport de pollens de brassicacées (moutarde, etc.). Une haute concentration de brassicacées en fleurs dans l’environnement du rucher en automne offrirait donc aux colonies des conditions comparables à celles trouvées dans l’environnement au printemps, au moment où la colonie est en pleine expansion. Les pollens récoltés fournissent des niveaux de nutriments correspondant aux activités des abeilles au cours de leur cycle annuel. Les concentrations de certains acides aminés diffèrent dans les pollens récoltés au printemps et à l’automne. De même pour la concentration en acides gras. Ceci n’est pas sans impact sur le développement des abeilles et leur santé. 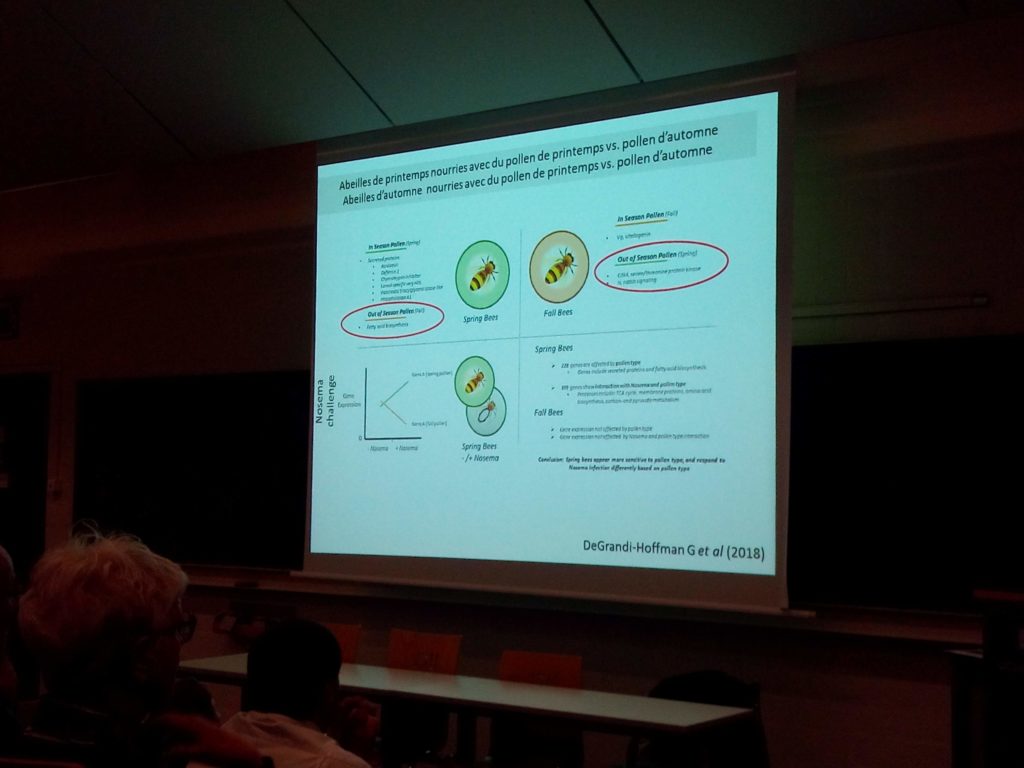
Que retenir?
1/ Les abeilles utilisent massivement les ressources procurées par les CIPAN (265 g/jour) avec une forte attraction observée pour la phacélie.
2/ Elles risquent une exposition aux pesticides en butinant les CIPAN.
3/ L’impact sur la colonie et l’hivernage est une question complexe qui implique la physiologie, la nutrition, les facteurs de stress et plusieurs mécanismes de régulation.
Une étude CIPAN 2018 est en cours pour affiner les observations.
(1) Münch, D., & Amdam, G. V. (2010). The curious case of aging plasticity in honey bees. FEBS letters, 584(12), 2496-250 – https://www.sciencedirect.com/science/article/pii/S0014579310002760
(2) Alaux, C., Allier, F., Decourtye, A., Odoux, J. F., Tamic, T., Chabirand, M., … & Henry, M. (2017). A ‘Landscape physiology’approach for assessing bee health highlights the benefits of floral landscape enrichment and semi-natural habitats. Scientific reports, 7, 40568. https://www.nature.com/articles/srep40568
(3) DeGrandi-Hoffman, G., Gage, S. L., Corby-Harris, V., Carroll, M., Chambers, M., Graham, H., … & Meador, C. (2018). Connecting the nutrient composition of seasonal pollens with changing nutritional needs of honey bee (Apis mellifera L.) colonies. Journal of insect physiology, 109, 114-124. https://www.sciencedirect.com/science/article/pii/S0022191018301124